Протеїни – біологічні полімерні молекули, які складаються із 20-ти різних амінокислот, беруть участь у всіх клітинних процесах, починаючи зі зчитування генетичної інформації (процес транскрипції) до синтезу білків (процес трансляції). Причому за рахунок взаємодії як із білками, так і з полімерами ДНК і РНК протеїни повністю контролюють життєвий цикл клітини – її ріст (проліферацію), а також загибель (некроз, апоптоз).
Нормальні клітини часом перетворюються на злоякісні, що призводить до виникнення новоутворень (пухлин) у організмі. Такі клітини отримали назву трансформованих. Вони характеризуються тим, що, на відміну від нормальних клітин, можуть ділитися нескінченну кількість разів і не гинуть, тобто не проходять через апоптоз. Наразі показано, що існують протеїни, які запобігають проліферації клітин, зупиняючи поділ клітин, а також такі, що активують апоптоз.
Тобто при дії таких білків на пухлинну клітину можна було би зупинити проліферацію або спричинити апоптоз. Але транспортування таких білків до клітини – складна і досі не вирішена проблема. Одним зі способів є введення у клітини спеціальних конструктів (на основі ДНК), які містять послідовність, що кодує певний протеїн. Проте основна перешкода для такої доставки (трансфекції) – те, що клітинна оболонка (мембрана клітин) не пропускає сторонню ДНК. Тому зазвичай або частково руйнують мембрану (розчином набору солей або пульсом електроенергії), або ДНК «загортають» у складну суміш жирних кислот і амінів жирних кислот. В останньому випадку ДНК потрапляє до клітин у так званих ліпосомах. Однак ДНК може зруйнуватися по дорозі й не потрапити до ядра, де відбувається транскрипція. Ба більше, у певних випадках протеїн може не синтезуватися.
Тож логічно було створити систему для доставки готових протеїнів у клітину, щоб обійти підводне каміння трансфекції. Науковці Інституту експериментальної патології, онкології і радіобіології імені Р.Є. Кавецького НАН України поставили собі за мету створити молекулярну систему для доставки певних білків у трансформовані клітини (клітини пухлин) за рахунок взаємодії наночастинок золота із протеїнами різних класів. Отримані експериментальні дані можуть стати основою для подальшого розроблення протипухлинної терапії.
Модельними протеїнами вчені Академії вибрали білки родини MRPS18 і білок, що контролює цілісність ДНК у клітині й апоптоз – ТР53. Робота виконувалась у кілька етапів. Спочатку було синтезовано наночастинки золота (НЧЗ) різного розміру (5-50 нм) та отримано вищезгадані протеїни у пробірці (виділено із бактеріальних культур). Далі протеїни було імобілізовано (приєднано) на поверхню НЧЗ та успішно доставлено у клітинні лінії ссавців у культурі за рахунок піноцитозу, тобто мебрана клітини захоплювала колоїдний розчин протеїнів на поверхні НЧЗ як краплю рідини.
Дослідники відзначають, що протеїни родини MRPS18 (1-3) на поверхні НЧЗ посилюють апоптоз пухлинних клітин, індукований високим рівнем протеїну ТР53 (див. рисунок нижче). Скажімо, як демонструє панель «контроль» (на рисунку – вгорі ліворуч), ядра пухлинних клітин (на ілюстрації позначені блакитним кольором) показують високий сигнал протеїну ТР53 (позначено зеленим кольором). Важливо, що при дії протеїнів родини MRPS18 (1-3) частина пухлинних клітин припиняє ділитись і формує агломерати апоптотичних клітин (позначено стрілками червоного кольору на трьох інших панелях). Ба більше, вчені довели, що протеїни родини MRPS18 на поверхні НЧЗ підвищували чутливість пухлинних клітин до дії протипухлинних препаратів – вінкристину і доксорубіцину.
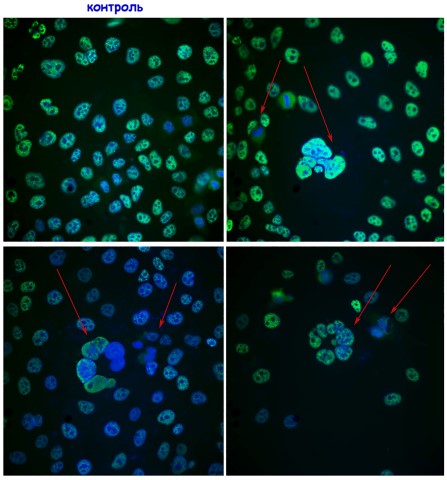 Дія протеїнів родини MRPS18 посилює апоптоз пухлинних клітин, спричинений білком ТР53 |
Важливість отриманих результатів науковці вбачають у тому, що, по-перше, використали наночастинки золота як носії протеїнів, а по-друге, запропонували ефективну систему доставки протеїнів у клітину (що впливатиме на життєздатність і проліферацію пухлинної клітини), створивши в такий спосіб підґрунтя для розроблення протипухлинних препаратів.
* * *
Як розповіла у коментарі пресслужбі НАН України керівниця досліджень – завідувачка лабораторії молекулярних механізмів трансформації клітин відділу моніторингу пухлинного процесу та дизайну терапії Інституту експериментальної патології, онкології та радіобіології імені Р.Є. Кавецького НАН України доктор біологічних наук Олена Кашуба, робота за цим напрямом тривала в 2015–2019 роках у межах виконання цільової комплексної програми фундаментальних досліджень НАН України «Фундаментальні проблеми наноструктурних систем, наноматеріалів, нанотехнологій» (проєкт 72/19Н, 0115U001380).
– Що наштовхнуло Вас із колегами на ці дослідження? Як виникла ідея?
– Ми багато вивчали взаємодію протеїнів між собою, причому використовували як методи клітинної біології, імунохімічні методи, так і методи біофізики – такі, як використання поверхневого плазмонного резонансу (ППР). ППР вивчають на поверхні тонкого шару золота, тому наступним кроком був перехід до наночастинок золота різної форми і розміру.
Ще однією причиною вивчення транспортування протеїнів у клітину є те, що всі клітинні процеси контролюються протеїнами, проте часом неможливо провести трансфекції низки клітин, бо складно модифікувати мембрану, або ж клітини надто чутливі до хімічних реагентів чи до імпульсу електричного струму.
– Чи вже опубліковано ваші наукові результати?
– Поки що тільки у тезах доповідей на конференціях, проте готуємо дві статті для фахових видань
– Чи маєте зв’язки з клініцистами та чи зацікавили їх ваші з колегами досягнення?
– Наразі про це зарано говорити. Ми ж отримали фундаментальний результат. Проте сам принцип доставки певної кількості протеїну у клітину заслуговує подальшого розроблення. Працюватимемо над цим далі.
 Головні виконавиці наукового проєкту – доктор біологічних наук Олена Кашуба (ліворуч) і старший науковий співробітник очолюваної нею лабораторії кандидат біологічних наук Лариса Ковалевська. Фото люб’язно надала Олена Кашуба |
За інформацією Інституту експериментальної патології,
онкології та радіобіології імені Р.Є. Кавецького НАН України
і Пресслужби НАН України