31 травня 2024 року в Інституті біохімії ім. О.В. Палладіна НАН України відбудеться чергове засідання міждисциплінарного загальноакадемічного семінару у галузі природничих наук «Актуальні питання фізико-хімічної та математичної біології».
Доповідь «Ключова роль аміноацил-тРНК синтетаз у біології та медицині» виголосить директор Інституту молекулярної біології і генетики НАН України академік Михайло Тукало.
 Академік Михайло Тукало (фото: пресслужба НАН України) |
Початок заходу – о 10:30 (орієнтовна тривалість – 2 години).
Адреса: Київ, вул. Леонтовича, 9, актова зала Інституту біохімії ім. О.В. Палладіна НАН України.
Посилання для дистанційного долучення до семінару:
https://meet.google.com/ete-wanq-rza УВАГА! У разі повітряної тривоги працює укриття в будівлі Президії НАН України (вул. Володимирська, 54).
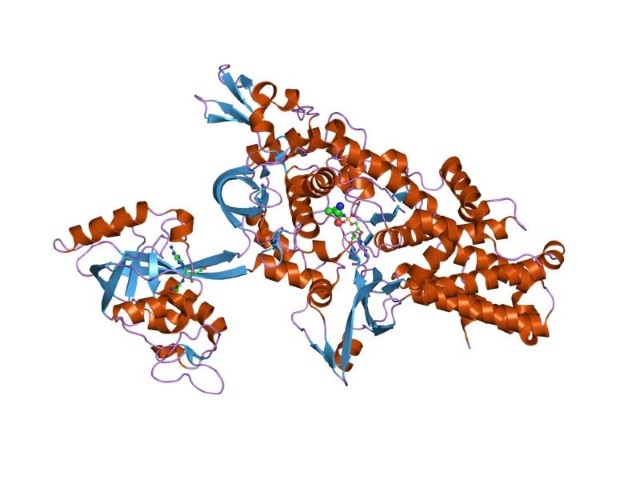 Лейцил-тРНК-синтетаза Thermus thermophilus (ілюстрація: en.wikipedia.org) |
Про тему доповіді
Аміноацил-тРНК синтетази (АРСази) – це група ферментів, присутніх у всіх живих організмах, походження яких тісно пов’язане з виникненням життя на Землі. Вони забезпечують точність трансляції генетичної інформації під час біосинтезу білка, приєднуючи амінокислоти до своїх споріднених тРНК. Однак різниці у спорідненості недостатньо для того, щоб АРСази чітко розрізняли амінокислоти з подібною структурою. Щоб подолати цю проблему, низка АРСаз в процесі еволюції набула здатності гідролізувати неправильно аміноацильовану тРНК у спеціальному редагованому домені. В Інституті молекулярної біології і генетики НАН України вивчали молекулярні механізми редагування синтетазами двох різних класів: лейцил-тРНК синтетазою Thermus thermophilus (LeuRSTT), що належить до 1-го структурного класу АРСаз, і проліл-тРНК синтетазою Enterococcus fecalis (ProRSEF) з 2-го класу. Щоб зрозуміти механізми реакції редагування для ферментів з абсолютно різною архітектурою доменів редагування, науковці Інституту використали низку підходів, зокрема рентгеноструктурний аналіз вивчення комплексів ферментів із субстратами, молекулярне моделювання, молекулярну динаміку, квантово-механічні (QM) розрахунки, сайт-спрямований мутагенез ферменту та модифікації тРНК. Це надзвичайно цікавий приклад співпраці фізиків, хіміків і біологів. Інтенсивний мутагенез сайтів редагування LeuRSTT і ProRSEF дав змогу ідентифікувати амінокислотні залишки в активному центрі, важливі для гідролізу. З іншого боку, модифікація tRNAPro на 2’-OH A76 і tRNALeu на 3’-OH A76 шляхом заміни кожної з них на протон виявила істотну функцію для цих груп у каталізі. На основі отриманих експериментальних результатів і власних розрахунків QM автори дослідження пропонують новий субстрат-залежний механізм посттрансферного редагування LeuRSTT і ProRSEF.
Ключова роль аміноацил-тРНК синтетаз у біосинтезі білка робить це сімейство перспективною мішенню для пошуку нових антибіотиків. АРСази прокаріотів і евкаріотів дещо різняться структурно, і цього може вистачити для конструювання інгібіторів із більшою селективністю до патогенних ферментів. Сьогодні супербактерії, тобто бактерії, стійкі до антибіотиків, кидають людству справжній виклик. Якщо не вжити термінових заходів, до 2050 року від хвороб, спричинених стійкими до антибіотиків бактеріями, на нашій планеті щороку помиратиме 10 мільйонів осіб, а економічний збиток становитиме 100 трильйонів доларів на рік. Тому підвищення ефективності розроблення нових антибіотиків є ключовим у розв’язанні цієї проблеми. Приклад роботи науковців Інституту молекулярної біології і генетики НАН України з ідентифікації та валідації нових мішеней – результати співпраці з компанією “Anacor Pharmaceuticals” (США), у підсумку якої розкрито новий механізм дії антибіотика: корегувальний домен синтетази як перспективна мішень для інгібіторів АРСаз. Нову мішень – лейцил-тРНК-синтетазу – було використано у подальших дослідженнях, пов’язаних із пошуком протитуберкульозних антибіотиків. Автори дослідження використовують відмінності між людською та мікобактеріальною лейцил-тРНК-синтетазою (LeuRSMT) і метіоніл-тРНК синтетазою (MetRSMT) для розроблення інгібіторів як потенційних ліків проти Mycobacterium tuberculosis. Стратегія пошуку антибактеріальних сполук базується на поєднанні рентгеноструктурного аналізу цільового білка, комп’ютерного моделювання взаємодії низькомолекулярних лігандів із цільовим білком і синтетичних процедур комбінаторної хімії. На першому етапі, щоб виявити інгібітори LeuRSMT, здійснюють молекулярний докінг бібліотеки сполук, яка містить близько 100 тисяч органічних сполук, до активного центру ферменту. Одна зі сполук, що пройшла всі етапи досліджень, виявилась активною щодо резистентних до ізоніазиду, рифампіцину й офлоксацину штамів M. tuberculosis. Було виявлено, що це похідне продемонструвало хороші властивості ADME in vitro і може бути цінним кандидатом для подальших доклінічних досліджень. Метою наступного кроку науковців Інституту молекулярної біології і генетики НАН України є розроблення сполук, які одночасно пригнічують мікобактеріальні LeuRSMT і MetRSMT, що дає змогу значно знизити або запобігти виникнення резистентності M. tuberculosis. Кілька сполук виявлено як подвійні інгібітори – це продемонстрували біохімічні аналізи значень IC50 in vitro для LeuRSMT і MetRSMT, і їхня активність проти клітин M. tuberculosis H37Rv.
Окрім своєї центральної ролі в процесі трансляції, АРСази мають ще й інші функції, а також стають ключовими гравцями у дедалі більшій кількості клітинних процесів, і це має далекосяжні наслідки для здоров’я людини. Лейцил-тРНК синтетаза людини (LARS1) діє як сенсор лейцину для комплексу 1 механістичної мішені рапаміцину (mTORC1) у ссавців, а також може функціонувати як білок, що активує ГТФазу (GAP) для субодиниці RagD гетеромерного активатора mTORC1. Порушення регуляції сигналізації mTORC1 призводить до багатьох захворювань людини, зокрема раку, ожиріння, епілепсії та діабету, тому компоненти шляху mTORC1 є потенційними мішенями для фармакологічних досліджень. В Інституті молекулярної біології і генетики НАН України досліджують структурні вимоги для запобігання взаємодії та передачі сигналу від LARS1 до mTORC1. Академік Михайло Тукало представить у своїй доповіді результати попередніх досліджень, які свідчать про пряму взаємодію між LARS1 і RagD. Нарешті, науковці Інституту в співпраці з колегами із інших закладів визначили низку хімічних сполук, що мають запобігати білок-білковій взаємодії LARS1/RagD і стати новими потенційними інгібіторами сигнального каскаду mTOR.
 |
Довідково
Міждисциплінарний загальноакадемічний семінар у галузі природничих наук «Актуальні питання фізико-хімічної та математичної біології» започатковано на базі Інституту біохімії ім. О.В. Палладіна НАН України відповідно до Постанови Президії НАН України № 134 від 22 березня 2023 р.
Мета семінару – періодичне заслуховування й обговорення наукових доповідей, присвячених застосуванню сучасних експериментальних і теоретичних методів хімії, фізики й математики для розв’язання нагальних проблем сучасної біології, зокрема у галузі біохімії, біофізики, молекулярної та клітинної біології, біоенергетики, геноміки, медичної біології, фармакології, нанобіотехнології, системної та синтетичної біології.
Семінар унеобхіднений прогресом таких «перехресних» наук і наукових напрямів, як біофізична хімія, фізична біохімія, хімічна біофізика, біохімічна фізика, фізико-хімічна біологія, фізика живого, математична біофізика, теоретична біологія, біоінформатика, штучний інтелект в біології та медицині тощо.
Засідання семінару щомісяця відбуваються в Актовій залі Інституту біохімії ім. О.В. Палладіна НАН України (Київ, вул. Леонтовича, 9). Долучитися до семінару можна також в онлайн-режимі. «Двері» семінару відкриті не лише для науковців Національної академії наук України та працівників і студентів українських закладів вищої освіти, а й для всіх охочих.
На засіданнях семінару з міждисциплінарними науковими доповідями вже виступили:
- заступник директора з наукової роботи Інституту проблем математичних машин і систем НАН України член-кореспондент НАН України Ігор Бровченко;
- директор Навчально-наукового інституту високих технологій Київського національного університету імені Тараса Шевченка доктор хімічних наук, професор Ігор Комаров;
- професор кафедри загальної та медичної генетики Навчально-наукового центру «Інститут біології і медицини» Київського національного університету імені Тараса Шевченка доктор біологічних наук Андрій Сиволоб;
- завідувач відділу медичної хімії Інституту органічної хімії НАН України, професор кафедри супрамолекулярної хімії Інституту високих технологій Київського національного університету імені Тараса Шевченка, науковий консультант компанії ТОВ «НПВ «Єнамін»» доктор хімічних наук Дмитро Волочнюк;
- завідувач лабораторії медико-біологічних досліджень відділу хімії макроциклічних сполук Інституту органічної хімії НАН України кандидат хімічних наук Роман Родік;
- професор кафедри загальної фізики та моделювання фізичних процесів фізико-математичного факультету Національного технічного університету України «Київський політехнічний інститут імені Ігоря Сікорського» доктор фізико-математичних наук Оксана Горобець;
- завідувач кафедри біофізики та медичної інформатики Навчально-наукового центру «Інститут біології та медицини» Київського національного університету імені Тараса Шевченка доктор біологічних наук, професор Олександр Жолос;
- директор Інституту проблем штучного інтелекту МОН України і НАН України член-кореспондент НАН України Анатолій Шевченко;
- головний науковий співробітник лабораторії біофізики макромолекул відділу теорії нелінійних процесів в конденсованих середовищах Інституту теоретичної фізики ім. М.М. Боголюбова НАН України доктор фізико-математичних наук, професор Сергій Волков;
- завідувач відділу білкової інженерії та біоінформатики Інституту молекулярної біології та генетики НАН України член-кореспондент НАН України Олександр Корнелюк;
- завідувач кафедри фізичної хімії хімічного факультету Київського національного університету імені Тараса Шевченка член-кореспондент НАН України Ігор Фрицький.
Наступне засідання семінару заплановано на червень 2024 року.
Пропозиції щодо виступів із доповідями (обсяг тез доповіді – 1–2 сторінки) надсилайте, будь ласка, на електронні скриньки керівника семінару – заступника директора з наукової роботи Інституту біохімії ім. О.В. Палладіна НАН України, завідувача відділу біохімії м’язів цього Інституту академіка Сергія Олексійовича Костеріна: kinet@biochem.kiev.ua ; kosterin.serg@gmail.com
За анонсами засідань семінару стежте також
на сайті Інституту біохімії ім. О.В. Палладіна НАН України.
За інформацією Інституту біохімії ім. О.В. Палладіна НАН України