Один із наукових проєктів, що у 2020–2021 роках виконувалися за ґрантами Національної академії наук України для молодіжних дослідницьких лабораторій і груп, має назву «Розробка багатомішеневих інгібіторів аміноацил-тРНК-синтетаз Staphylococcus aureus та амілоїд-чутливих флуоресцентних зондів для детекції впливу інгібіторів на біоплівку». Реалізували цей проєкт молоді науковиці Інституту молекулярної біології і генетики НАН України у складі старшого наукового співробітника відділу біомедичної хімії кандидата біологічних наук Галини Волинець (керівниця проєкту), наукового співробітника відділу ензимології білкового синтезу кандидата біологічних наук Марії Рибак, наукового співробітника відділу біомедичної хімії кандидата біологічних наук Світлани Черній, старшого наукового співробітника відділу регуляторних механізмів клітини кандидата біологічних наук Оксани Горбатюк, наукового співробітника відділу регуляторних механізмів клітини кандидата біологічних наук Марії Усенко та старшого наукового співробітника відділу функціональної геноміки кандидата біологічних наук Ольги Юнгін. Чому ці дослідження важливі та яких результатів досягли його виконавиці – розповідаємо далі.  Виконавиці молодіжного наукового проєкту (зліва направо): Світлана Черній, Галина Волинець (керівниця), Марія Усенко, Ольга Юнгін, Оксана Горбатюк |
Один із найтривожніших викликів для сучасної медицини – проблема множинної стійкості патогенних мікроорганізмів до антибіотиків. Пошукові нових підходів і молекулярних рішень для подолання цієї проблеми присвячується підтримане ґрантом Національної академії наук України дослідження групи молодих учених Інституту молекулярної біології і генетики НАН України на чолі з кандидатом біологічних наук Галиною Волинець. У фокусі їхньої уваги – золотистий стафілокок (Staphylococcus aureus), збудник низки захворювань: від шкірних інфекцій до смертельно небезпечних хвороб, таких як менінгіт, ендокардит, бактеремія, сепсис, остеомієліт, некротизуюча пневмонія тощо. Саме цей мікроорганізм є основною причиною спалахів внутрішньолікарняних інфекцій.
Золотистий стафілокок надзвичайно стійкий у зовнішньому середовищі, може виживати протягом 12 годин при повному сонячному освітленні та здатен витримувати температуру 150 ºС протягом 10 хвилин. На сьогодні S. aureus набув стійкості фактично до всіх наявних антибіотиків.
З часу відкриття пеніциліну та його активного використання у стафілокока виникла мутація, що призвела до резистентності. Коли в світі закінчилась «ера пеніциліну», у клінічній практиці з’явився метицилін – хімічно модифікований пеніцилін. Проте згодом виникли метицилін-резистентні штами золотистого стафілокока, а також штами, стійкі до ванкоміцину. В Україні за останні роки рівень резистентності до ванкоміцину стрімко зріс – від 0 до 64,3%. Слід зазначити, що нині не існує ефективнішого за ванкоміцин антибіотика для лікування метицилін-резистентних стафілококових інфекцій (за винятком, у деяких випадках, лінезоліду, що його використовують для лікування пневмонії, спричиненої стафілококовою інфекцією). Ці два антибіотики є фактично останнім та єдиним інструментом контролю резистентних форм S. aureus.
Чому ж виникає антибіотикорезистентність у патогенних мікроорганізмів? Одну з провідних ролей тут відіграє формування біоплівок. Біоплівки – це багатоклітинний консорціум мікроорганізмів, де клітини вбудовані в позаклітинний матрикс, найчастіше прикріплений до твердої поверхні. Наш ворог – золотистий стафілокок – може утворювати біоплівки на імплантованих медичних приладах (центральному венозному катетері, серцевих клапанах, тазостегнових протезах тощо) та на ранових поверхнях, що значно ускладнює процес лікування, адже виникає стійкість патогена як до імунної системи пацієнта, так і до антибіотиків.
Тому надзвичайно важливим завданням сучасної науки є пошук нових підходів і молекулярних мішеней для подолання множинної стійкості S. aureus до антибіотиків. Зокрема,необхідно знайти способи порушення формування біоплівки.
Увага дослідників, які розроблюють антибіотики, зосереджена на таких молекулярних мішенях, як аміноацил-тРНК-синтетази – ферменти, що є ключовими на першому етапі біосинтезу білка. Аміноацил-тРНК-синтетази бактерій та людини мають певні структурні відмінності, і це важливо враховувати під час розроблення інгібіторів (речовин-уповільнювачів хімічних реакцій в організмі), які селективно діятимуть на бактеріальні ферменти, що, своєю чергою, суттєво знизить їхню (інгібіторів) токсичність для організму людини.
Нині як перспективний напрям у боротьбі з антибіотикорезистентністю розглядають багатомішеневу терапію, тобто застосування ліків, які діють одночасно на кілька білків. Це дозволить значно знизити ризик розвитку стійкості до антибіотиків, адже ймовірність виникнення мутацій одночасно у кількох білках є незначною.
Білки золотистого стафілокока, залучені у формування біоплівки, збагачені такими амінокислотами, як серин і треонін. Саме роль цих білків є ключовою в колонізації біоплівки та подальшому поширенні інфекції у нашому організмі. Як припускають учені, ферменти серил-тРНК-синтетаза та треоніл-тРНК-синтетаза можуть бути вдалими молекулярними мішенями для розроблення інгібіторів, які використовуватимуться проти стафілококової інфекції. Ймовірно, розроблені інгібітори порушуватимуть формування біоплівки S. aureus, оскільки досліджувані ферменти залучені у синтез ключових послідовностей амілоїдогенних білків.
Варто зауважити, що функціональні амілоїди (особливі сукупності білків) дуже важливі для формування та функціонування біоплівок, їхньої стійкості. Але «розгледіти» їх (як, власне, й самі біоплівки) складно. Річ у тім, що до позаклітинного матриксу біоплівки входить низка біомолекул (нуклеїнових кислот, білків), тож комерційно доступні флуоресцентні барвники не мають достатньої специфічності до функціональних амілоїдів бактерій – іншими словами, вони не дають змоги чітко їх візуалізувати. Тому ще одним завданням групи молодих вчених Інституту молекулярної біології і генетики НАН України було розроблення новітніх флуоресцентних барвників для дослідження біоплівок.
Оскільки проєкт мультидисциплінарний, до складу групи ввійшли молоді науковці з кількох структурних підрозділів Інституту молекулярної біології і генетики НАН України – як фахівці в різних галузях біології.
Наприклад, керівниця проєкту – кандидат біологічних наук Галина Волинець – спеціалізується на комп’ютерному моделюванні. За допомогою такого підходу як молекулярний докінг учена здійснила оцінку взаємодії колекції сполук відділу біомедичної хімії Інституту, що налічує понад 100 тисяч речовин, з активними центрами досліджуваних ферментів. Це перший етап раціонального дизайну ліків. Програми молекулярного докінгу дозволяють передбачити вигідне положення сполуки у центрах зв’язування білка, а також обчислюють енергію взаємодії. Далі дослідник відбирає кілька тисяч сполук для візуального перегляду в комплексі з білками. Зрештою, для дослідження in vitro (а воно досить коштовне, бо потребує значної кількість матеріалів і реактивів) зі 100 тисяч сполук необхідно відібрати лише кілька сот. Це надзвичайно творчий і відповідальний процес, від якого залежить кінцевий результат проєкту.
Відповідальні виконавиці проєкту – кандидати біологічних наук Марія Рибак, Оксана Горбатюк і Марія Усенко – висококваліфіковані фахівчині з молекулярної біології та ензимології. Вони вперше клонували ген треоніл-тРНК-синтетази S. aureus і отримали рекомбінантні ферменти – серил-тРНК-синтетазу та треоніл-тРНК-синтетазу – в клітинах бактерій кишкової палички Escherichia coli, які далі були використані для тестування активності відібраних сполук.
 Кандидат біологічних наук Марія Рибак за роботою |
Спільними зусиллями дослідниці знайшли інгібітори треоніл-тРНК-синтетази серед п’яти хімічних класів. Активність інгібіторів є невисокою, але це перші у світі інгібітори треоніл-тРНК-синтетази золотистого стафілокока, інформацію про яких
опубліковано у фаховій літературі – престижному журналі ACSOmega (видається Американським хімічним товариством; імпакт-фактор – 3.5).
У співпраці з Інститутом епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України молоді вчені Інституту молекулярної біології і генетики НАН України дослідили антибактеріальну активність найперспективніших інгібіторів необхідних ферментів – серил-тРНК-синтетази та треоніл-тРНК-синтетази. Для досліджень було використано шість мультирезистентних штамів золотистого стафілокока: два стандартні штами та чотири госпітальні (з лікарень Києва).
Урешті, вчені знайшли дві сполуки, що суттєво пригнічували ріст S. aureus. Однак, вивчаючи дію цих сполук на біоплівку, науковиці зіткнулися з проблемою їх розчинення. Тому основним критерієм подальшого відбору стала розчинність відібраних речовин. Кінець кінцем, вдалося підібрати сполуку серед похідних N-бензиліден-N’-(4,5-дигідро-[1,2,4]триазин-3-іл)-гідразину, що має високий антибактеріальний та антибіоплівковий ефект (зі значенням МІС = 32 мг/л) і не чинить антибактеріального впливу на грам-негативну бактерію E.coli. Науковиці також з’ясували, що знайдена сполука є ефективною щодо низки госпітальних мультирезистентних штамів золотистого стафілокока.
Іншу частину проєкту – присвячену розробленню флуоресцентних зондів для вивчення структурних елементів біоплівки – виконували кандидати біологічних наук Світлана Черній та Ольга Юнгін. Вони розробили специфічні ціанінові флуоресцентні барвники для візуалізації функціонального амілоїдного компонента біоплівки золотистого стафілококу. Завдяки цьому можна окремо побачити бактеріальні клітини та позаклітинні функціональні амілоїди у товщі матриксу біоплівки. Важливо, що розроблені Світланою Черній та Ольгою Юнгін флуоресцентні барвники зв’язуються з амілоїдними фібрилами біоплівки бактерій і не взаємодіютьіз нуклеїновими кислотами.
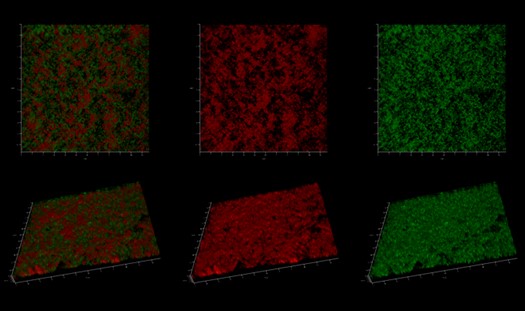 Триденна жива біоплівка S. aureus 25923, пофарбована стандартним барвником SYBR Green, що використовується для мічення нуклеїнових кислот (зелений) та розробленого вченими Інституту молекулярної біології і генетики НАН України барвника D-51, що зв’язується з амілоїдними фібрилами (червоний) |
* * *
Виконавиці проєкту висловлюють вдячність:
- виконувачці обов’язків завідувача лабораторії медичної мікробіології з музеєм патогенних для людини мікроорганізмів Інституту епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України Анні Вишняковій – за дослідження антибактеріальної активності сполук на патогенних штамах S. aureus;
- науковому співробітникові відділу синтетичних біорегуляторів Інституту молекулярної біології і генетики НАН України кандидату хімічних наук Дмитрові Криворотенку – за синтез флуоресцентних барвників;
- старшому науковому співробітнику відділу регуляторних механізмів клітини Інституту молекулярної біології і генетики НАН України кандидатові біологічних наук Олені Мошинець – за допомогу в дослідженні флуоресцентних барвників на біоплівках S. aureus.
За інформацією Інституту молекулярної біології і генетики НАН України